内源性金属离子在细胞门控转运和代谢中发挥重要生理功能;如铁、铜离子的代谢失调会通过调控细胞内氧化应激状态导致细胞发生铁死亡、铜死亡。血管内皮由于炎症和氧化应激导致损伤是动脉粥样硬化(Atherosclerosis,AS)发生发展的始动因素之一;如何控制血管内皮中的炎症和氧化应激稳态,防治AS进展已成为领域内研究的热点和难点。
11月1日,药学院于超、阳章友团队在Nature子刊Nature Communications杂志在线发表了题为“Small molecule-assisted assembly of multifunctional ceria nanozymes for synergistic treatment of atherosclerosis”的最新研究成果。该研究借鉴了团队早期探究铁死亡调控内皮损伤(Autophagy, 2021,17,12)和铜死亡途径对内皮损伤影响(Free Radical Bio Med,2018, 129, 268)的研究成果;前期研究发现了内皮损伤与铁、铜离子通过在细胞内发生“芬顿反应”扰乱细胞内氧化应激微环境存在正相关,离子价态变化参与其中。通过反向思维,引入外源性金属铈离子阻止“芬顿反应”,从而维持细胞内氧化应激稳态,保护血管内皮细胞免受损伤。为了将一定价态铈离子有效递送进细胞发挥作用,联系到磷酸在核酸链上的链接作用,设计了独特配体唑来膦酸(ZOL)与金属离子通过自组装串在一起的策略。开发了一种具有酶活性和药物递送能力的仿生铈纳米酶药物(PCZ@PB NCs)用于动脉粥样硬化治疗。

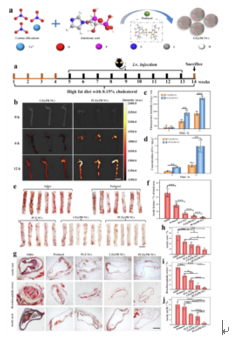
该团队发现含有双膦酸和咪唑基团的双配体小分子能够与铈离子自组装形成新的铈-MOF-likely纳米结构。考虑生物相容性与安全性,筛选出唑来膦酸(ZOL)为连接分子,合成了具有多种酶模拟活性和均匀尺寸的全新铈纳米酶(CZ NCs)。该纳米酶因结构特性可以载特定的荧光染料或药物分子,因此具有良好的诊疗应用前景。团队选择难溶性抗炎药物普罗布考(PB)自组装合成PB负载的铈纳米酶药物,进一步通过对炎性病灶有着高亲和力的血小板膜进行外部仿生化处理,得到靶向损伤血管内皮的铈纳米酶药物(PCZ@PB NCs),不仅可以降低微环境的ROS和炎症因子表达水平,并且通过主-被动双重靶向富集于AS病灶,协同药物抑制巨噬细胞泡沫化,最终实现有效改善病理微环境,达到抗AS的效果。这项研究开发了一种通用的组装技术来合成具有纳米酶活性和药物递送能力的仿生化铈纳米酶药物。这种新型铈纳米酶药物极大地拓展了金属铈离子在生物医学领域的应用。
药学院博士研究生付晓雪为论文的第一作者;阳章友和于超为论文共同通讯作者。
全文链接:https://www.nature.com/articles/s41467-022-34248-y
