心血管疾病是高患病率、高致残率和高死亡率的常见病,降脂抗炎的药物治疗是心血管疾病的主要治疗方式。随着科学技术的进步,利用CRISPR/Cas9基因编辑技术对基因组特定目标进行修饰的特点研发相关的基因药物成为了疾病治疗的前沿领域。如何将CRISPR/Cas9基因编辑系统高效、特异性递送进细胞发挥基因编辑功能是限制该技术临床应用的关键瓶颈。
4月21日,于超教授团队在Advanced Science上在线发表题为“CES1‐Triggered Liver‐Specific Cargo Release of CRISPR/Cas9 Elements by Cationic Triadic Copolymeric Nanoparticles Targeting Gene Editing of PCSK9 for Hyperlipidemia Amelioration”的最新研究成果。

该研究针对PCSK9蛋白靶点设计的CRISPR/Cas9基因编辑的两种RNA组分(Cas9-mRNA/sgRNA)高效稳定地递送进肝细胞,并在胞质内有效释放,首先合成了新型肝细胞特异性的肝酯酶(CES1)响应二甲双胍衍生三元共聚物(mPEG-b-P(Met/n-PMA),该共聚物带有正电荷,通过与带负电荷的Cas9-mRNA/sgRNA自组装形成稳定的纳米递送系统。这种递送系统由于设计了CES1特异性剪切片段,可以有效在肝细胞的胞质内响应CES1酶切,释放Cas9-mRNA启动Cas9蛋白表达,在NLS肽引导下携带sgRNA入核进行基因编辑。研究表明mPEG-b-P(Met/n-PMA)/Cas9-mRNA/sgPCSK9纳米粒在肝细胞中有效积累,显著抑制PCSK9蛋白的表达,并有效降低小鼠血清中低密度脂蛋白胆固醇和总胆固醇水平。
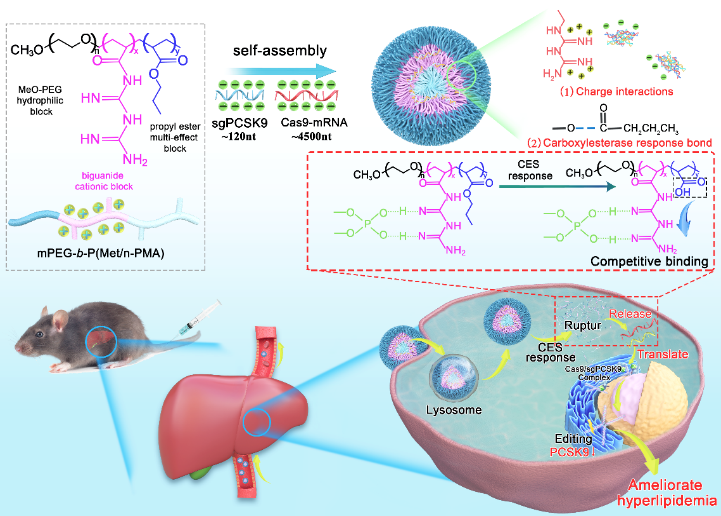
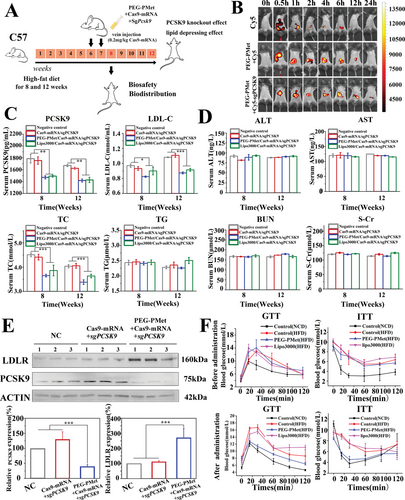
该研究建立了一种全新的大分子核酸递送体系,实现了复杂的CRISPR/Cas9基因编辑RNA成分的稳定加载、安全递送和靶向释放。这种新型递送系统,拓展了CRISPR/Cas9基因编辑技术在心血管疾病治疗药物研发领域的应用,突破该类技术的瓶颈,为进一步临床应用奠定了理论基础。
这项研究是该团队继前期研发的分子印迹药物(Chem. Eng. J. ,2022,430(2):132870)、金属酶药物(Nat. Commun., 2022,13:6528)等新型前沿性新药以来,又一次取得的创新性研究成果。
重庆医科大学药学院博士研究生赵云飞,博士后王帆,脂质中心博士后李韵为该文共同第一作者;药学院于超教授为该文主要通讯作者。该研究由重庆市科技创新与应用发展专项项目资助。
原文链接:https://doi.org/10.1002/advs.202300502
